Dientamoeba fragilis y urticaria crónica espontánea: una perspectiva zoonótica basada en el principio de “Una Salud” sobre la interacción entre humanos y parásitos
Resumen
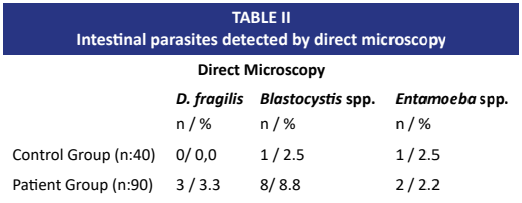
Dientamoeba fragilis (D. fragilis), es un parásito zoonótico intestinal, y representa una de las posibles causas de la urticaria crónica espontánea. El objetivo de este estudio es investigar la asociación entre la urticaria y la presencia de D. fragilis, así como comparar métodos diagnósticos. Además, este estudio busca destacar el potencial zoonótico de Dientamoeba fragilis dentro del enfoque “Una Sola Salud”, basado en la interacción entre la salud humana, la salud animal y los factores ambientales. El estudio incluyó a 90 pacientes humanos con urticaria crónica espontánea y 40 individuos sanos. Se realizó un examen microscópico directo de las muestras de heces mediante el método nativo con Lugol. Se aisló el ADN de las muestras de heces y se realizó la reacción en cadena de la polimerasa en tiempo real para su identificación. La incidencia de D. fragilis fue significativamente mayor en pacientes con urticaria crónica espontánea 17/90 (18,9%) en comparación con los controles sanos 1/40 (2,5%) (P= 0,0261). En el examen microscópico directo de muestras de heces de pacientes con urticaria crónica espontánea, se detectó D. fragilis en 3 (2,3%) de las muestras. No se detectó D. fragilis en las muestras de heces de voluntarios sanos mediante microscopía directa. Sin embargo, la reacción en cadena de la polimerasa en tiempo real reveló ADN de D. fragilis en una muestra sana. Los datos indican que D. fragilis puede tener un impacto en los trastornos inflamatorios crónicos de la piel. Además, el estudio destaca el valor de las técnicas moleculares, como la reacción en cadena de la polimerasa en tiempo real, para una detección más precisa de parásitos zoonóticos.
Descargas
Citas
Vezir S, Kaya F, Vezir E, Karaosmanoglu N, Adiloglu AK. Evaluation of intestinal parasites in patients with chronic spontaneous urticaria in a territory hospital in Turkey. J. Infect. Dev. Ctries. [Internet]. 2019; 13(10):927-932. doi: https://doi.org/p9m9 DOI: https://doi.org/10.3855/jidc.11552
Kolkhir P, Muñoz M, Asero R, Ferrer M, Kocatürk E, Metz M, Xiang YK, Maurer M. Autoimmune chronic spontaneous urticaria. J. Allergy Clin. Immunol. [Internet]. 2022; 149(6):1819-1831. doi: https://doi.org/gr96qc DOI: https://doi.org/10.1016/j.jaci.2022.04.010
Zuberbier T, Bernstein JA, Maurer M. Chronic spontaneous urticaria guidelines: What is new? J. Allergy Clin. Immunol. [Internet]. 2022; 150(6):1249-1255. doi: https://doi.org/gs6bnz DOI: https://doi.org/10.1016/j.jaci.2022.10.004
Kaplan A, Lebwohl M, Giménez-Arnau AM, Hide M, Armstrong AW, Maurer M. Chronic spontaneous urticaria: Focus on pathophysiology to unlock treatment advances. Allergy. [Internet]. 2023; 78(2):389-401. doi: https://doi.org/gs6bpg DOI: https://doi.org/10.1111/all.15603
Kolkhir P, Bonnekoh H, Metz M, Maurer M. Chronic Spontaneous Urticaria: A Review. JAMA. [Internet]. 2024; 332(17):1464-1477. doi: https://doi.org/p9nb DOI: https://doi.org/10.1001/jama.2024.15568
Bernstein JA, Maurer M, Saini SS. BTK signaling—a crucial link in the pathophysiology of chronic spontaneous urticaria. J. Allergy Clin. Immunol. [Internet]. 2024; 153(5):1229-1240. doi: https://doi.org/p9nc DOI: https://doi.org/10.1016/j.jaci.2023.12.008
Yetismis G, Yildirim A, Pekmezci D, Duzlu O, Ciloglu A, Onder Z, Simsek E, Ercan N, Pekmezci GZ, Inci A. First report and genotyping of Dientamoeba fragilis in pet budgerigars (Melopsittacus undulatus), with zoonotic importance. Zoonoses Public Health. [Internet]. 2022; 69(5):572-578. doi: https://doi.org/p9nf DOI: https://doi.org/10.1111/zph.12949
Van Kalleveen MW, Van Gool T, Klarenbeek N, Benninga MA, Savelkoul PHM, De Meij T, Plötz FB. Dientamoeba fragilis in children: a systematic review on diagnostic considerations and efficacy of treatment. Expert. Rev. Gastroenterol. Hepatol. [Internet]. 2020; 14(4):231-242. doi: https://doi.org/p9n7 DOI: https://doi.org/10.1080/17474124.2020.1739520
Veraldi S, Maronese CA, Nazzaro G, Daprai L. Anal pruritus caused by Dientamoeba fragilis. Travel Med. Infect. Dis. [Internet]. 2022; 48:102319. doi: https://doi.org/p9n9 DOI: https://doi.org/10.1016/j.tmaid.2022.102319
Clemente L, Pasut M, Carlet R, Ruscio M, Fontana F. Dientamoeba fragilis in the North-East of Italy: Prevalence study and treatment. Parasitol. Int. [Internet]. 2021; 80:102227. doi: https://doi.org/p9pc DOI: https://doi.org/10.1016/j.parint.2020.102227
Tolba MM, Allam AF, Khalil SS, Elshouki WM, Shehab AY. Evaluation of microscopy and PCR for detection of Dientamoeba fragilis. Trop. Parasitol. [Internet]. 2022; 12(2):87-93. doi: https://doi.org/p9pd DOI: https://doi.org/10.4103/tp.tp_93_21
Oliveira-Arbex AP, David EB, Cacciò SM, Da Fonseca CRB, Martin JG, Kurokawa SC, Tosini F, Souza-Neto JA, Guimarães S. Prevalence and genetic characterization of Dientamoeba fragilis in asymptomatic children attending daycare centers. Rev. Inst. Med. Trop. Sao Paulo. [Internet]. 2021; 63:e39. doi: https://doi.org/p9pg DOI: https://doi.org/10.1590/s1678-9946202163039
Intra J, Sarto C, Besana S, Tiberti N, Brambilla P. The importance of considering the neglected intestinal protozoan parasite Dientamoeba fragilis. J. Med. Microbiol. [Internet]. 2019; 68(6):890-892. doi: https://doi.org/p9ph DOI: https://doi.org/10.1099/jmm.0.000983
Nagata N, Marriott D, Harkness J, Ellis JT, Stark D. Current treatment options for Dientamoeba fragilis infections. Int. J. Parasitol. Drugs Drug Resist. [Internet]. 2012; 2:204-215. doi: https://doi.org/p9pj DOI: https://doi.org/10.1016/j.ijpddr.2012.08.002
Maçin S, Kaya F, Çağdaş D, Hizarcioglu-Gulsen H, Saltik- Temizel IN, Tezcan İ, Demir H, Ergüven S, Akyön Y. Detection of parasites in children with chronic diarrhea. [Internet]. Pediatr. Int. 2016; 58(6):531-533. doi: https://doi.org/f8txx6 DOI: https://doi.org/10.1111/ped.12959
Gough R, Barratt J, Stark D, Ellis J. Diversity profiling of xenic cultures of Dientamoeba fragilis following systematic antibiotic treatment and prospects for genome sequencing. Parasitology. [Internet]. 2020; 147(1):29-38. doi: https://doi.org/p9pk DOI: https://doi.org/10.1017/S0031182019001173
Sánchez I, Dashti A, Köster PC, Bailo B, González N, Allende J, Stensvold CR, Carmena D, González-Barrio D. Development, Optimisation and Validation of a Novel Multiplex Real-Time PCR Method for the Simultaneous Detection of Cryptosporidium spp., Giardia duodenalis and Dientamoeba fragilis. Pathogens. [Internet]. 2022; 11(11):1277. doi: https://doi.org/p9pm DOI: https://doi.org/10.3390/pathogens11111277
Montraveta-Querol M, Bovo MV, Roig-Abraham N, Roig- Abraham N, Romaní N, Alcaraz A, Fernández-Riva, G. Should Dientamoeba fragillis be looked for in pediatric digestive pathology of an unknown cause? A proposed pilot case-control study. Enferm. Infecc. Microbiol. Clin. [Internet]. 2022; 40(8):436-440. doi: https://doi.org/p9pn DOI: https://doi.org/10.1016/j.eimc.2022.03.007
Cacciò SM, Sannella AR, Manuali E, Tosini F, Sensi M, Crotti D, Pozio E. Pigs as natural hosts of Dientamoeba fragilis genotypes found in humans. Emerg. Infect. Dis. [Internet]. 2012; 18(5):838-841. doi: https://doi.org/p9pq DOI: https://doi.org/10.3201/eid1805.111093
Destoumieux-Garzón D, Mavingui P, Boetsch G, Boissier J, Darriet F, Duboz F, Fritsch C, Giraudoux P, Le Roux F, Morand S, Paillard C, Pontier D, Sueur C, Voituron Y. The One Health concept: 10 years old and a long road ahead. Front. Vet. Sci. [Internet]. 2018; 5:14. doi: https://doi.org/gc35sx DOI: https://doi.org/10.3389/fvets.2018.00014
Fakhar M, Ghaffari J, Dabbaghzadeh A, Charati JY, Ghaffari B, Esboei BR. Prevalence of intestinal parasites among patients with chronic urticaria in Northern Iran. Infect. Disord. Drug Targets. [Internet]. 2021; 21(1):130-133. doi: https://doi.org/pfwz DOI: https://doi.org/10.2174/1871526520666200428095729
Muhsin-Sharafaldine MR, Rahman LA, Suwanarusk R, Grant J, Parslow G, French N, Tan KSW, Russell B, Morgan XC, Ussher JE. Dientamoeba fragilis associated with microbiome diversity changes in acute gastroenteritis patients. Parasitol. Int. [Internet]. 2023; 97:102788. doi: https://doi.org/p9pr DOI: https://doi.org/10.1016/j.parint.2023.102788
Shirvani G, Fasihi-Harandi M, Raiesi O, Bazargan N, Zahedi MJ, Sharifi I, Kalantari-Khandani B, Nooshadokht M, Shabandoust H, Mohammadi MA, Ebrahimipour M, Babae Z. Prevalence and Molecular Subtyping of Blastocystis from Patients with Irritable Bowel Syndrome, Inflammatory Bowel Disease and Chronic Urticaria in Iran. Acta Parasitol. [Internet]. 2020; 65(1):90-96. doi: https://doi.org/p9ps DOI: https://doi.org/10.2478/s11686-019-00131-y
Caffarelli C, Cuomo B, Cardinale F, Barberi S, Dascola CP, Agostinis F, Franceschini F, Bernardini R. Aetiological factors associated with chronic urticaria in children: a systematic review. Acta Derm. Venereol. [Internet]. 2013; 93(3):268-272. doi: https://doi.org/ghvs3k DOI: https://doi.org/10.2340/00015555-1511
Boga JA, Rojo S, Fernandez J, Rodriguez M, Iglesias C, Martinez-Camblor P, Vázquez F, Rodríguez-Guardado A. Is the treatment of Enterobius vermicularis co-infection necessary to eradicate Dientamoeba fragilis infection?. Int. J. Infect. Dis. [Internet]. 2016; 49:59-61. doi: https://doi.org/f8w4f3 DOI: https://doi.org/10.1016/j.ijid.2016.05.027
Aykur M, Kurt CC, Erdogan DD, Avci BC, Vardar R, Aydemir S, Girginkardeşler N, Gündüz C, Dagci H. Investigation of Dientamoeba fragilis prevalence and evaluation of sociodemographic and clinical features in patients with gastrointestinal symptoms. Acta Parasitol. [Internet]. 2019; 64(1):162-170. doi: https://doi.org/p9pt DOI: https://doi.org/10.2478/s11686-018-00017-5
Menendez C, Fernandez-Suarez J, Boga-Ribeiro JA, Rodriguez-Perez M, Vazquez F, Gonzalez-Sotorrios NA, Rodríguez-Guardado A. Epidemiological and clinical characteristics of Dientamoeba fragilis infection. Enferm. Infecc. Microbiol. Clin. [Internet]. 2019; 37(5):290-295. doi: https://doi.org/p9px DOI: https://doi.org/10.1016/j.eimc.2018.07.008
Stark D, Barratt J, Chan D, Ellis JT. Dientamoeba fragilis, the neglected Trichomonad of the human bowel. Clin. Microbiol. Rev. [Internet]. 2016; 29(3):553-580. doi: https://doi.org/f8wrgg DOI: https://doi.org/10.1128/CMR.00076-15
De Jong MJ, Korterink JJ, Benninga MA, Hilbink M, Widdershoven J, Deckers-Kocken JM. Dientamoeba fragilis and chronic abdominal pain in children: a case-control study. Arch. Dis. Child. [Internet]. 2014; 99(12):1109-1113. doi: https://doi.org/p9p3 DOI: https://doi.org/10.1136/archdischild-2014-305942
Sentürkoğlu F, Samadzade R, Korkmaz H, Maçin S. Investigation of Blastocystis spp. in patients with inflammatory bowel disease by direct microscopy and molecular methods. Afr. Health Sci. [Internet]. 2025; 25(1):74-83. doi: https://doi.org/p9p6 DOI: https://doi.org/10.4314/ahs.v25i1.8
Musayeva L, Saylam-Kurtipek G, Özden Ö, Macin S. Detection of Blastocystis spp. in patients with urticaria and identification of subtypes using sequencing techniques. Rev. Cient. FCV-LUZ. [Internet]. 2025; 35(2):1-5. doi: https://doi.org/p9p7 DOI: https://doi.org/10.52973/rcfcv-e35617